一石激起千层浪。
随着国家药品监督管理局药品审评中心(CDE)7月2日发布“关于公开征求《以临床价值为导向的抗肿瘤药物临床研发指导原则》意见的通知”(以下简称《指导原则》),引起医药行业资本市场巨大震动。
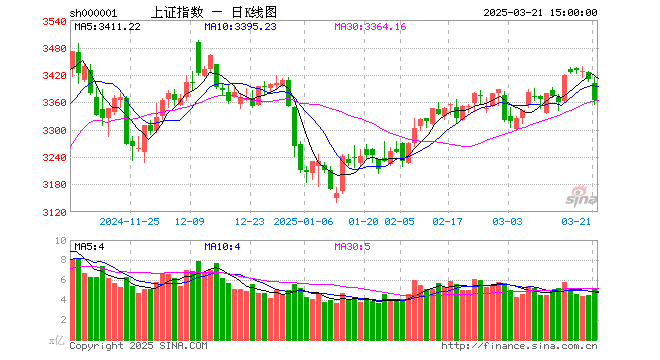
随着消息的发酵,7月6日收盘,此前一直强势的医药板块迎来重大调整,医药板块领跌A股。
其中,医药龙头复星医药跌9.64%;“牙茅”通策医疗跌停,“眼茅”爱尔眼科跌7.66%。在医药板块细分领域中,跌势最为凶猛的要属CRO概念股。Wind编制的CRO指数盘中暴跌接近9%,多只相关个股跌幅超过10%,或触及跌停。CRO股龙头药明康德(维权)A股跌5.1%。此外,A股另两只CRO头部企业泰格医药大跌10.92%,康龙化成大跌7.63%。
由于创业板指数的权重股有多只医药股,相关股票的大跌拖累创业板指数走低,截至上午收盘,创业板指数下跌2.32%。
深圳某医药行业投资人对21世纪经济报道记者表示,随着《指导原则》的公布,或将成为国内创新药投资市场的转折点,创新药的投资逻辑也面临变化,未来将不再看管线数量,而是看进度和深度。CXO的逻辑也变了,如果创新药临床三期数量大幅下降,CXO的增长逻辑在哪儿呢?
新规影响解读
华南某券商医药分析人士对21世纪经济报道记者表示,新规受冲击较大的仍是创新药企业,IVD体外检测和疫苗行业的影响不大,今天市场可能是恐慌情绪外溢,产生了对医药整体行业地“错杀”,当然板块轮动也是影响市场的原因之一。
《指导原则》提出,“以临床价值为导向”进行抗肿瘤药物研发,既以为患者提供更优的治疗选择为最高目标,当选择非最优的治疗作为对照时,即使临床试验达到预设研究目标,也无法说明试验药物可满足临床中患者的实际需要,或无法证明该药物对患者的价值。这意味着,新药在疗效方面要打败已经上市且疗效最好的药,方能上市。
而此新政一出,市场分析人士普遍将《指导原则》解读成利空。
部分市场人士认为,《指导原则》对进行me-too、me better类药物研发的企业提出了更高的要求,而作为它们下游研发外包服务商的CRO行业可能面临订单数量减少等情况,或将因此“迎来结构分化”。
同时也有分析指出,CDE新规对创新药企来说,利好开发进度快的公司,利空开发进度慢的公司。关键变量是,在进行3期临床时候,适应症的标准推荐疗法是否发生变化。例如:现在肝癌一线推荐疗法是PD-L1+仑伐替尼,那么现在肝癌一线药物3期临床对照组就是PD-L1+仑伐替尼,可能就不是此前对照的索拉菲尼。那么目前肝癌适应症已经进入3期临床的公司可能就是利好,没有进入的未来就会面临对照组更换,一方面对临床药物疗效要求更高,另一方面临床采购PD-L1+仑伐替尼的成本也比索拉菲尼高几倍。
而对CXO企业来说,同样是一个分化,利好资源能力强的头部公司。关键变量为,是否有能力加速开发、更快推进临床进度。例如:某头部CXO公司在调研中曾表示,公司临床前开发时间可以缩短3-6个月,临床时间也有进一步缩短空间。很明显,对于未来分秒必争的市场环境,拥有快速开发和临床能力的CXO公司将会取得更多订单。
值得一提的是,me-too类药物本身是以原研药为基础,在规避后者化学结构专利后进行研发的一类“新药“,它可能效果更好、也可能效果更差,实际并不绝对。
既然是“新药“,也就意味着me-too药物的临床,与现有要求一致,需与标准推荐治疗药物作疗效对比。新指导原则本身不会要求必须要跟原研药做“头对头”临床,除非原研药已经上市,并获得标准推荐疗法。
me-too型药物开发主要用于规避专利约束,国内me-too药物过度竞争的本质是IP环境不甚严格,加上国内药企模仿能力强、短期资本大量投入某一领域,造成了过度竞争。随着政策不断完善,未来通过市场自发出清,此类情况将得到有效缓解。
加快国产创新药步伐
新规的出台也客观上促进了国产创新药的发展进程。
回首国产创新药发展历史,在郑筱萸时代,药品审批注册门槛低到用钱就能敲开,药品临床试验数据大量造假,大量劣质、无效药通过审批进入市场。
在层层加价、医院回扣之后,百姓为此买单。医药的评判标准一度被临床医生降低到“无效没关系,只要安全,吃不死人,就是好药”的地步,2005年到2015年,整整十年,中国医药产业几近停滞。
2015年,60岁的毕井泉,出任原国家食品药品监督管理总局局长。毕井泉不仅面对的是停滞十年的医药产业,更棘手的是背后的游戏规则,药品审批制度该何去何从,改革所引发的一系列问题又该如何处置?
然而,这个被看做是医学领域“外行”的监管掌舵者开始了大刀阔斧的改革,在半年的时间里将此前积压的2万余件药品申报全部处理,被业界戏称的“7.22惨案”便由此而来。2015年7月22日,国家食药监局发布公告,对申请上市的1622个药品注册申请,要求企业自查,数据不真实的要主动撤回。
2015年5月份,震动社会各界的银杏叶提取物造假处罚事件,牵涉上百家企业,罚款上亿——这是毕井泉上任后第一次、也是过去十年药监部门第一次重拳出击药品安全事件,这一案直接推动了医药界的改革步伐。
2015年11月份,当国家食药监局陆续把核查结果公布,数据不真实、不完整的企业和医疗机构被立案调查。当看到同济医院、协和医院和301医院等大三甲医院,都未能幸免时,企业大规模的申请撤回潮开始,最终,有85.5%撤回。
同年8月,国务院以国发〔2015〕44号印发《关于改革药品医疗器械审评审批制度的意见》。该文件被称为中国创新药历史上最重要的“44号文”,在《意见》中明确提出提高药品审批标准;推进仿制药质量一致性评价;加快创新药审评审批;开展药品上市许可持有人制度试点;落实申请人主体责任;及时发布药品供求和注册申请信息;改进药品临床试验审批;严肃查处注册申请弄虚作假行为;简化药品审批程序,完善药品再注册制度;改革医疗器械审批方式;健全审评质量控制体系;全面公开药品医疗器械审评审批信息。总之,“44号文”重新定义了新药和仿制药,提高了医药的审评门槛,经修改后,新药的审评标准和美国FDA一致:此前境内外都未上市的药,才能称为新药;仿制药也从仿制有国家标准的药,直接提高为“原研药”。
毕井泉主导的药品供给侧改革为中国医药创新打开了一个新时代。
但好景不长,国内广泛效仿的“license in”(产品引进)之路,利用中国和海外的“效率差”大肆盈利,医药创新时长再次陷入困境。“低水平重复”开始成为整个创新药行业的代名词,以前讲的Me too也开始变成We too。
有业内人士直言,License in模式逐渐被玩坏,变成了赚钱工具,大家不是通过这个东西去做新药,而是为了快速套现离场。
而7月2日CDE发布的《指导原则》明确提出“以临床价值为导向”进行抗肿瘤药物研发,力求规范肿瘤药科学的新药研发,也一定程度上有助于扭转之前的“license in”模式下出现的问题。
前述医药行业投资人士对21世纪经济报道记者说道:“创新药和CXO行业下一发展阶段因此更应该迎来结构分化,而不是单纯利空。同时,可以看到政策文件的制定思路在不断推进创新药市场化,疗效不佳的药物本就会在市场应用中淘汰。”
(实习生文若楠对本文亦有贡献)
(作者:唐唯珂 编辑:徐旭)
牛市来了?如何快速上车,金牌投顾服务免费送>>