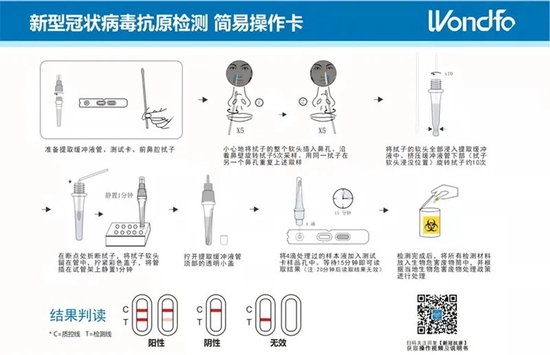
这个周末,新冠抗原检测试剂成为了市场最热话题。
新冠抗原检测试剂的上架销售时间点,成为市场关心的焦点。3月13日午间,有消息传出,老百姓大药房分销广州万孚生物的第一批新冠抗原快测产品预计将于3月14日上午起在线下门店和线上同步上架销售。但随后,有媒体报道称,老百姓分销的抗原检测试剂可能将推迟上架,或需补足相关资质。
零售价格也是市场热议的话题。券商中国记者在美团外卖APP上看到,有药店已经上架了新冠抗原检测试剂盒,该产品售价为32.8元/份,目前为预售状态,预计20号发货。另外,有媒体报道,老百姓大药房的门店销售价格约为30元/支,具体到货时间尚未确定。
据国家药监局发布的最新通告,批准南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的新冠抗原产品自测应用申请变更。意味着,这5家公司大概率将抢得先机,或将率先上架销售。其中,万孚生物、深圳华大因源(华大基因)、诺唯赞均为A股公司。
据不完全统计,生产抗原自测试剂的A股公司至少有二三十家,那么,接下来会批准哪些公司的抗原自测试剂,成为市场关注的重点。
新冠抗原产品即将开卖
国家卫健委的一纸文件,让新冠抗原检测试剂成为了A股市场最关注的焦点之一。
谁将拔得头筹?新冠抗原检测试剂何时上线销售?售价多少?成为了市场热议的主要话题。
3月12日,国家药监局发布通告,批准南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的新冠抗原产品自测应用申请变更。
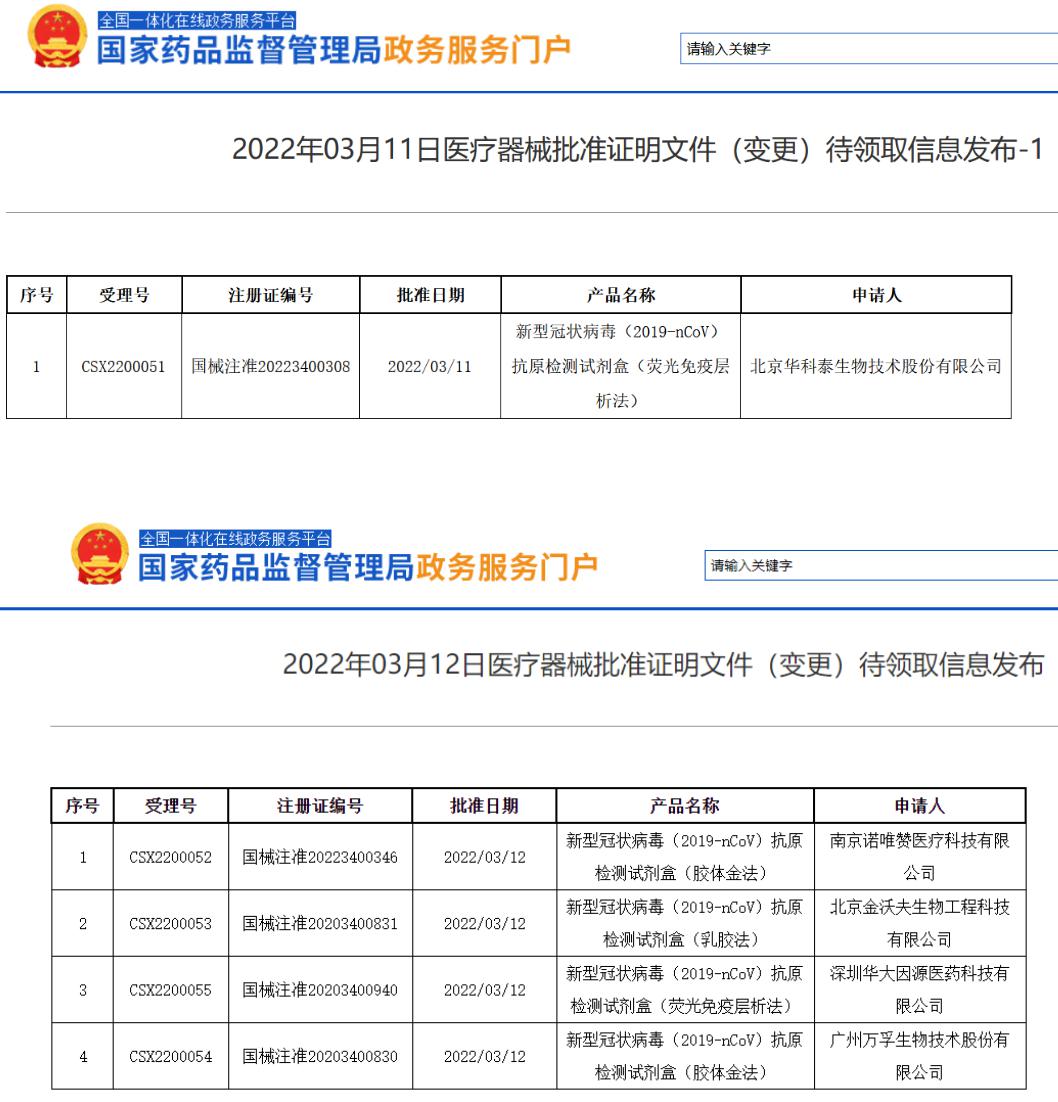
意味着,这5家公司大概率将抢得先机,上述5款新冠抗原产品或将率先上架销售。其中,万孚生物、深圳华大因源(华大基因)、诺唯赞均为A股公司。
3月13日,有消息传出,老百姓大药房分销广州万孚生物的第一批新冠抗原快测产品预计将于3月14日上午起在线下门店和线上同步上架销售。
但随后,第一财经报道,老百姓分销的抗原检测试剂可能将推迟上架。老百姓方面回复称,目前万孚生物的新冠抗原自测产品还在湖南总部的仓库中,上海的药房还需要新建目录、上级审批才可以入库;有的药店还需要办理销售这一产品的资质,预计还要2周时间才能上架销售。
另外,有业内人士向媒体表示,当下万孚生物由于没有更换抗原检测试剂的说明书等内容,已被要求暂时在OTC渠道下架,并待更换产品说明书后再重新上架。
另一家大型连锁药房——大参林的销售人员表示,目前仅接到了产品即将上线通知,具体时间点待定,产品还未送过来,可能还要过几天。
在新冠抗原检测产品的放量预期下,市场机构资金早已提前入场扫货。3月11日,A股的新冠检测、新冠药物等抗疫题材板块掀起涨停潮,兰卫医学、博拓生物、奥泰生物、亚辉龙、万孚生物均斩获20CM涨停板,九安医疗、赛力医疗等超20股封板。
连锁药店板块也集体大涨,老百姓、大参林的股价涨幅分别达6.8%、9.77%,二者总市值分别升至176.8亿元、268.4亿元。
面对这一波风口,有人试图违规“抢跑”销售。3月12日晚间,万孚生物发布声明称,近日,公司研发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)进行了医疗器械批准证明文件变更,现发现有部分个人及公司未经我公司合法授权,擅自通过电商以及其他线上渠道进行非法售卖宣传。

万孚生物表示,对于上述未经公司合法授权、擅自通过电商以及其他线上渠道、宣称可销售公司研发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)产品的个人及公司,万孚生物保留向相关公安部门报案并追究相应法律责任的权利。
市场空间有多大
当前,市场关心的另一个问题是,国内的新冠抗原检测试剂的零售价格将会是多少?
3月13日,券商中国记者在美团外卖APP上看到,有药店已经上架了新冠抗原检测试剂盒,但为预售,预计20号发货,该产品的1人份预售价格为32.8元,25人份的预售价为498元,该试剂盒的厂家为北京金沃夫。

另外,据澎湃新闻3月13日报道,老百姓大药房的门店工作人员表示,目前,新冠抗原自测产品还无法购买,需要先登记预约,具体到货时间尚未确定,该门店首批只有100盒,价格是596元/20支,单支的价格约为30元/支。
有媒体报道称,北京金沃夫生物工作人员介绍,除国际订单外,公司将开足马力生产全力供货国内订单,把抗原检测试剂盒产能提高到170万人份/天,指导零售价将低于50元/人份的核酸检测价格。
据悉,新冠抗原检测产品分为POC专业版(医院用)和家用自测,二者的价格有所差别。有医药电商平台负责人透露,万孚生物的新冠抗原自测产品在医院的中标价为16.8元/支,零售平台的售价应该会有一定的上浮。有大参林门店员工透露,万孚生物的新型冠状病毒抗原检测试剂盒线下售价386元/盒,内含20份试剂,即单次检测价格为19.3元。
参考西方市场,在新冠抗原检测试剂中,家用自测占比较高,市场空间更为广阔。如果按照20-30元/支的零售价格计算,新冠抗原自测产品的国内市场规模将达到多少?
中泰证券在研报中指出,参考海外发放政策,海外新冠抗原自检试剂盒的发放频次差别显著,在人均2-10次不等,如国内抗原自检试剂盒正式放开,参考海外政策按照最低频率假设每月人均2次。以此计算,国内新冠抗原自检试剂产品的终端零售市场规模或将达560-840亿元/月。
但业内人士指出,如果未来新冠抗原检测方式在国内铺开,国内市场的需求量增加,不排除国家医保集中采购的可能性,届时新冠抗原产品的价格将进行招标,最终的出厂价格可能会大幅下降。
上市公司纷纷表态
尽管国家药监局的第一批名单中,仅有5家公司5款产品,但面对即将放开的国内增量市场,其他玩家自然不甘落后,大概率将积极申报。
目前,国内已有上百家体外诊断生产企业的新冠抗原自检试剂盒,在海外注册获批,在欧洲、马来西亚等地区市场竞争也日益激烈,使得产品售价更加市场化。
有分析人士认为,随着新冠抗原产品在国内市场铺开后,在国内获批上市的企业数量大概率也会逐渐增加。
其实,在国家卫健委发布《新冠病毒抗原检测应用方案(试行)》后的第一时间,九安医疗便表示,新冠病毒抗原检测产品将作为医疗器械,待国家药监局药品审评中心(CDE)审批后方可国内上市。关于购买方式,政府集采、个人药店购买、网络购买都可能会有。
去年底,中国医药保健品进出口商会官网更新了取得国外标准认证或注册的医疗物资生产企业清单,新型冠状病毒检测试剂新增九安医疗、必欧瀚生物、东方生物获美国EUA注册认证。
而近2日以来,A股投资者互动平台关于新冠抗原检测试剂的问题越来越多,上市公司也纷纷在平台上表态。
3月11日晚间,东方生物公告表示,截至目前,公司新冠抗原检测试剂尚未取得国内认证证书,后续取得证书公司将履行公告义务。尽管东方生物表示尚未取得国内认证证书,但东方生物作为国内最早开发新冠抗原快速检测技术的企业之一,是国内首家获得新冠抗原快速诊断CE认证的企业。
同日晚间,明德生物公告称,公司新冠抗原检测试剂已向国家药品监督管理局提交注册申请,该注册证的取得时间尚存不确定性。
鱼跃医疗表示,公司自主研发的新冠抗原检测产品,分为院用版与家庭自测版,其中院用版已通过CE认证,家庭自测版的欧盟CE认证和美国FDA紧急使用授权(EUA)公司尚在积极推进中,公司会紧密跟踪海内外相关市场情况,积极布局推动业务发展。
迪安诊断表示,新冠病毒抗原检测试剂盒主要在德国、奥地利等欧洲国家销售,也已在香港打开销路。
圣湘生物日前在互动平台表示,目前可居家自测使用的新冠抗原检测产品已在申请欧盟CE认证及美国FDA认证,将进一步为国际疫情的防控提供多样化的鉴定和检测方案,提升公司产品的综合竞争力。
垒知集团也表示,参股公司奥德生物新冠病毒抗原检测试剂的日均产能约300万人份,目前产品主要销往德国市场。
责编:战术恒
投资避险工具看这里,低风险理财、7%+收益、0手续费>>