新冠抗原自测产品就要来了!
深圳华大因源、广州万孚生物等五款新冠抗原自测产品获批在国内上市。3月13日,国大、大参林等药房进行了网络预售,国大药房的预售价格一人份为32.8元,到货时间预计为一周。
记者今日上午走访广州各大连锁药房发现,新冠抗原检测试剂还没有在广州药店上架。
零售药房开始预售
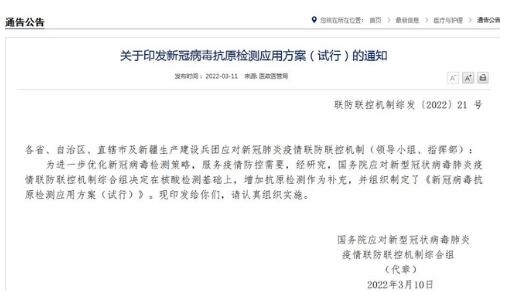
国家卫健委3月11日晚发消息称,国务院联防联控机制综合组公布《新冠病毒抗原检测应用方案(试行)》,决定推进“抗原筛查、核酸诊断”的监测模式,在核酸检测基础上增加抗原检测作为补充。社区居民有自我检测需求的,可通过零售药店、网络销售平台等渠道,自行购买抗原检测试剂进行自测。
3月12日,国家药监局发布通告,深圳华大因源、广州万孚生物、北京华科泰生物的新冠抗原产品自测应用申请变更。自此五款新冠抗原自测产品获批在国内上市。
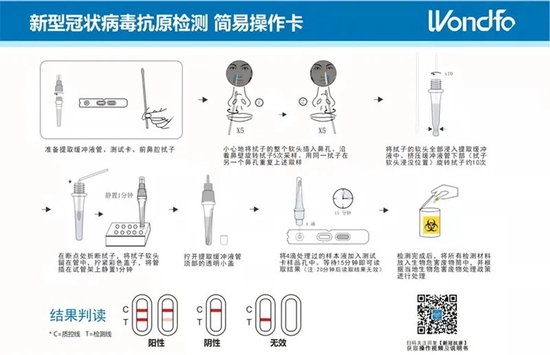 万孚生物新型冠状病毒抗原检测简易操作图
万孚生物新型冠状病毒抗原检测简易操作图记者发现,广东国大药房对新冠自测盒进行了预售。记者进入预订群发现,国大药房预售的两款自测盒来自北京金沃夫生物工程科技有限公司和广州万孚生物技术股份有限公司。
“预售价格一人份为32.8元。目前有两种规格,小包装是一人份一盒,大包装是25人份一盒。”记者获悉,具体的零售价到货后才进行统一公布,药房通过邮寄的方式进行配送。另外,国大药房表示,预订人数较多,到货时间估计需要一周。
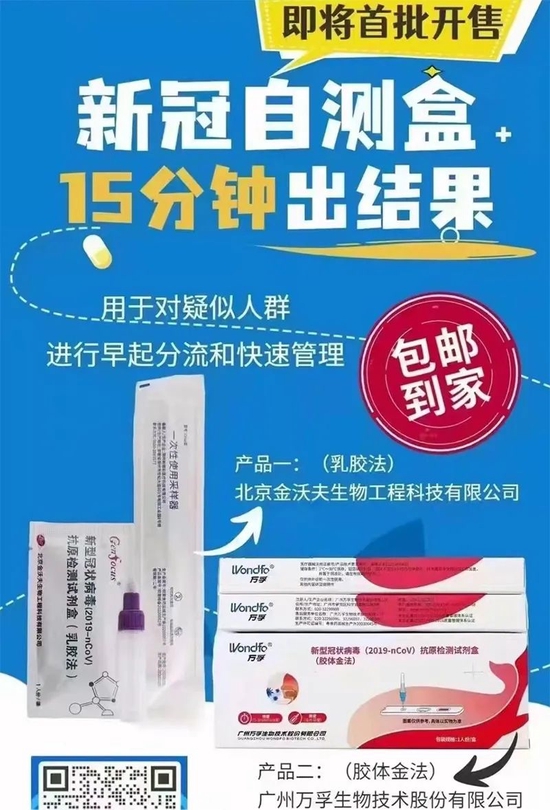 国大药房预售海报
国大药房预售海报老百姓12日表示,公司大药房与广州万孚生物达成合作,第一批新冠抗原快测产品已在物流运输途中,预计近日将在门店上架销售。首批产品将登陆老百姓大药房位于上海、湖南、江苏等 12 个省市的门店。

据了解,老百姓大药房分销广州万孚生物的第一批新冠抗原快测产品预计将于14日上午起在线下门店和线上同步上架销售。
电商平台开启预售
除了线下零售药店,线上电商平台也有新动作。
3月13日,记者发现美团买药已经率先上线新冠抗原自测产品。据体验,用户登陆美团App或美团外卖App进入买药频道后,即可在页面内进行购买,此外搜索“新冠抗原自测”或点击美团买药频道内“新冠自测”专区,也可以找到相关产品。

记者在美团买药今日发布的购买页面看到,该产品为新冠抗原检测试剂盒,预约购买后会在3月20日发货,用户可以根据产品说明书进行居家自测,15分钟至20分钟便可观察到结果。
美团买药相关负责人对上海证券报记者表示,3月13日起,用户即可通过美团买药频道中全国发货的药店预约购买相关产品,商家将于20日起使用快递为用户发货;同时美团买药也已经联合老百姓大药房、国大药房、高济医疗、海王星辰、大参林药房、泉源堂药房等多家连锁药店,预计将在一周内与线下药店同步上架新冠抗原自测产品,共同为用户提供30分钟送药上门的服务。
“希望能让用户更方便地购买、使用新冠抗原试剂盒。”美团买药相关负责人表示,将持续积极协调产品供给,与各方力量一起更好地保障相关产品的上线和销售,共同守护大家的健康生活。
此外,高济医疗旗下医疗新零售平台高济健康Pro3月12日晚也发布消息称,高济医疗与广州万孚生物、南京诺唯赞、深圳华大因源、北京金沃夫等多家公司正在紧密合作,第一批新冠抗原快测产品很快将会在河南、江西、辽宁几个市场率先上架销售,同时将通过高济健康Pro微信小程序为全国顾客提供线上订购服务。
新冠抗原自测产品尚未上架
新冠抗原自测产品获批的信息公布后,12日当晚已经有药房迅速进行了宣传,并表示第一批新冠抗原自测产品已在物流运输途中,预计近日将在门店上架销售。
上证报记者13日上午走访广州各大药房发现,并没有见到新冠抗原自测产品的踪影。
“我们最快的来货时间是下周二。”大型连锁药店广州番禺某店长向记者表示。
记者在向药店店员咨询新冠抗原快测产品到货情况时,店员要求再次查验记者的健康码和检测体温,在确认无误后,才开始向记者介绍起目前没有到货的情况。
“从3月11号新冠抗原检测政策发布后,公司就开始积极组织货源。”大参林公司相关人士向记者介绍,“公司的反应也非常快,基本上都是24小时在跟进所有的东西,包括资料准备和审核、组织货源、后台手续、门店培训等等。目前已经在提货中,今天自测试剂应该会上货的,现在已经在接受预定了。”
他也表示,公司也在网络上做了预售,深圳市场预订非常积极。
“前期不少药店都在抢货,我们开始的货量相对会紧张,不太稳定。我们会把货源侧重于深圳、广州、东莞这些城市。” 大参林相关人士表示。
上述人士表示,公司组织的新冠抗原试剂一盒大概为20份,每份的价格还需要最后确认。对于定价的情况,自测产品的利润率会相对较低,可能会跟2020年时的口罩利润率相当。
抗原自测结果不能取代核酸报告
“新冠抗原自测试剂一份价格比核酸检测便宜不少,关键是检测方便!如果能进医保更好!全民自测最大的好处是减少外出感染风险,极大减轻社区和前线志愿者的工作压力。” 大参林相关人士表示。
值得关注的是,抗原自测结果不能取代核酸报告。
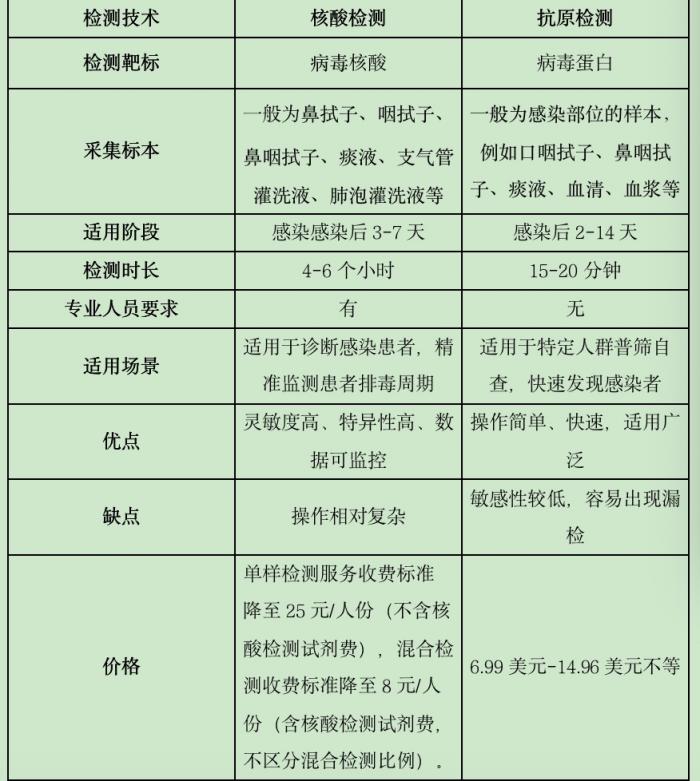
据了解,当前的监测模式为“抗原筛查、核酸诊断”,核酸检测依然是新冠病毒感染的确诊依据。抗原检测作为补充手段可以用于特定人群的筛查,有利于提高“早发现”能力,一般用于急性感染期,即疑似人群出现症状7天之内的样本检测。
试行方案中的《新冠病毒抗原自测基本要求及流程》也指出,抗原检测一般用于急性感染期,即疑似人群出现症状 7 天之内的样本检测。疑似人群抗原阳性及阴性结果均应当进行进一步的核酸检测,阳性结果可用于对疑似人群的早期分流和快速管理,但不能作为新冠病毒感染的确诊依据。
国家传染病医学中心主任、上海新冠肺炎临床救治专家组组长、复旦大学附属华山医院感染科主任张文宏表示,相比抗原检测,核酸检测会更准一些,依然是新冠病毒感染的确诊依据,但是抗原检测作为补充手段用于筛查,如果阳性的话基本就能确诊,如果阴性的话要多测几次也能提高敏感性和阳性率,或者通过核酸检测来确诊。
万孚生物3月12日称,公司研发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)产品不能单独用于新型冠状病毒感染的诊断,应结合核酸检测、影像学等其他诊断信息及病史、接触史判断感染状态。阳性结果可以用于对疑似人群进行早期分流和快速管理,但阳性结果仅表明样本中存在新型冠状病毒抗原,不能作为新型冠状病毒感染的确诊依据。
翰宇药业联手两方开展“家用型新冠病毒抗原检测试剂盒”研发
3月13日,国家感染性疾病临床医学研究中心官网消息,3月11日,深圳国家感染性疾病临床医学研究中心、深圳市第三人民医院与翰宇药业签订约束性意向书,独家授权翰宇药业开展“家用型新型冠状病毒抗原检测试剂”商业化开发、注册及销售。
本次约束性意向协议签署后,深圳国家感染性疾病临床医学研究中心、深圳市第三人民医院将对临床样本资源及检测资源快速完成真实样本的验证,完成抗原试剂盒临床研究,协同翰宇药业共同致力于开发灵敏度及特异性更好的产品。
上述三方将以此解决目前抗原检测还存在的漏检及假阳性等共性问题,进一步提高“早发现”的能力,方便医疗机构及家庭个人对新冠病毒进行快速、及时的筛查,促进患者早期诊断与及时干预,更好地服务疫情防控需要。
深圳市第三人民医院是深圳新冠肺炎患者唯一定点救治医院,也是深圳疫情防控的“主战场”,在临床上累积了丰富的新冠患者救治经验及病例数据,在毒株研究和抗原检测方面拥有强大的优势。
翰宇药业表示,公司获得国家感染病临床研究中心、深圳市第三人民医院就“家用型新冠病毒抗原检测试剂盒”全球独家授权,是公司覆盖新型冠状病毒等感染类疾病从预防、检测、到治疗的全产业链布局重要突破。
美国微生物科学院院士、深圳市第三人民医院院长卢洪洲教授表示,自检试剂产品无须专业医师指导,可以在居民家庭内部快速完成,15-20分钟即可得出结果,能有效减少对医院、第三方实验室的资源占用,可用于居民大范围的普筛自查。
国家药监局:严查违法生产经营新冠抗原检测试剂
居家自测新冠肺炎大大提高了防疫检测效率,但是消费者在购买相关产品还需注意商家资质是否齐全,谨防买到假冒伪劣产品。
3月12日晚间,万孚生物发布声明称,近日,万孚生物研发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)进行了医疗器械批准证明文件变更,现发现有部分个人及公司未经万孚生物合法授权,擅自通过电商以及其他线上渠道进行非法售卖宣传。
万孚生物表示,上述产品不能单独用于新型冠状病毒感染的诊断,应结合核酸检测、影像学等其他诊断信息及病史、接触史判断感染状态。对于上述未经万孚生物合法授权、擅自通过电商以及其他线上渠道、宣称可销售该产品的个人及公司,万孚生物保留向相关公安部门报案并追究相应法律责任的权利。
国家药监局3月12日印发通知,要求各级药品监督管理部门加强注册相关管理、生产环节监督检查、经营环节监督检查等工作,严厉打击违法违规行为。
国家药监局表示,在疫情防控期间,销售新冠病毒抗原检测试剂的相关零售药店和企业需取得药品经营许可证或者医疗器械经营许可证,并具备相应储存条件。
国家药监局要求,各省级药品监督管理部门要继续加强对新冠病毒检测试剂网络交易信息的监测处置力度,对监测发现的违法违规线索要及时组织查处。加强对辖区医疗器械网络交易服务第三方平台的监督检查,监督指导其严格履行对入网医疗器械经营者的实名登记、资质审核、经营行为管理等义务,发现违法违规销售医疗器械行为,要及时制止并报告药品监督管理部门。对未经许可生产经营、生产经营未经注册新冠病毒抗原检测试剂等违法违规行为,要依法从严查处。涉嫌犯罪的,要及时移送公安机关。
多家A股公司回应抗原检测产品情况
3月11日,新冠抗原检测产品的关注度陡升,当日也成为互动平台的热点话题。
3月11日,圣湘生物在互动平台表示,目前,可居家自测使用的新冠抗原检测产品已在申请欧盟CE认证及美国FDA认证,将进一步为国际疫情的防控提供多样化的鉴定和检测方案,提升公司产品的综合竞争力。
3月11日,安科生物在互动平台称,公司研发的新型冠状病毒(COVID-19)IgG/IgM抗体检测试剂盒(胶体金法),于2020年3月取得欧盟CE认证,产品后续情况以公司公告为准。

3月11日,鱼跃医疗在互动平台称,公司自主研发的新冠抗原检测产品,分为院用版与家庭自测版。其中,院用版已通过CE认证,公司尚在积极推进家庭自测版的欧盟CE认证和美国FDA紧急使用授权(EUA)。公司会紧密跟踪海内外相关市场情况,积极布局推动业务发展。
3月11日,迈克生物在互动平台称,公司新冠抗原自测产品已获得澳大利亚TGA注册,“家用检测”欧洲CE的注册工作正在积极推进中。
3月11日,垒知集团在互动平台称,公司参股公司奥德生物介绍,德国联邦疫苗和生物医学实验室(Paul-Ehrlich-Institut)对全球的122款CE认证的新冠检测产品进行了测试评估,结果在国际知名医学期刊Eurosurveillance发布,奥德生物生产的新冠病毒抗原检测试剂的综合性能排名第七,超过多家国际知名品牌。德国多家零售商、医院已大批量采购奥德生物试剂盒,目前已取得约1亿人份的新冠病毒抗原检测试剂的订单。
目前,奥德生物的新冠病毒抗原检测试剂,日均产能约300万人份,产品主要销往德国市场。
而在3月11日之前,已有投资者关注到新冠抗原检测的市场需求。
3月9日,华大基因在互动平台上表示,在新冠检测产品方面,目前公司已形成病毒测序、核酸检测、核酸快检、抗原快检、抗原自测、抗体快检、中和抗体检测等多产品覆盖体系,可满足不同使用需求及应用场景。
3月13日晚间,华大基因公告称,公司控股子公司深圳华大因源医药科技有限公司于近日,取得国家药品监督管理局(下称“国家药监局”)颁发的《中华人民共和国医疗器械注册变更文件(体外诊断试剂)》,对新冠抗原检测产品的医疗器械注册证进行了变更。
本次华大因源新冠抗原检测产品医疗器械注册证的变更,主要系根据《新冠病毒抗原检测应用方案(试行)》等国家相关规定,对产品预期用途、说明书、储存条件及产品有效期进行了变更。
抗原检测是直接针对病毒中的特有蛋白质(即抗原)进行检测,能够在急性感染期快速检出阳性病例,可以用于特定人群筛查的补充检测手段,有利于提高“早发现”能力,对优化新冠病毒检测策略和整体疫情防控具有重要作用。
华大基因表示,上述获证产品需与干式荧光免疫分析仪适配使用,检测结果稳定性高、特异性好,并具备自动判读检测结果和信息化管理检测样本的优势。
3月9日,新产业在互动平台称,公司已于2021年建立了胶体金平台,研发推出的公司新冠抗原检测试剂盒(胶体金法),已于2021年9月取得CE准入资格。对于提及国内新冠抗原自测产品,以公司相关公告为准(如有涉及)。
3月9日,ST东洋(维权)在互动平台称,公司全资子公司艾维可生物科技有限公司已取得欧盟准入资质的新型冠状病毒(SARS-CoV-2)抗原检测试剂盒(胶体金法),主要采集通过鼻咽拭子、唾液等样本进行操作。
3月9日,迪安诊断在互动平台称,公司有15分钟新冠快速检测盒,目前新冠抗原检测产品的产能是每日60万人份。通过扩建厂房及流程优化等方式,未来会提升至每日100万人份。现阶段迪安生物的任务是建立海外销售渠道和体系,主要在德国、奥地利等欧洲国家销售,暂未有国内销售计划。

3月8日,万孚生物在互动平台称,公司是国内唯一获得新冠抗原检测和新冠抗体检测双注册证的企业。公司的新冠抗原检测试剂盒,也是我国首批获得医疗器械注册证的新冠病毒抗原检测试剂之一,可实现辅助诊断、患者管理及危急重症检测,可应用于定点医院、疾控中心、基层医疗等专业场景。
万孚生物当前海外及欧洲市场仍以新冠抗原自测试剂需求为主,于去年6月已经获得了新冠抗原自测的欧盟CE认证,2021年前三季度公司新冠业务实现收入约为8亿元。公司新冠业务收入的大部分,来自新冠抗原自测产品的海外销售贡献。公司会继续关注欧洲各国的疫情发展及市场需求,积极对接相关业务。新冠抗原产品在美国FDA的注册,公司正在积极推进中。
3月4日,明德生物在互动平台称,公司有来自香港的新冠抗原检测试剂订单,但占总收入的比例较小,请投资者注意相关投资风险。公司新冠抗原检测试剂有居家自用产品且已获得CE认证,并陆续在欧洲和东南亚多数国家获得白名单准入。公司抗原检测试剂主要销售地区为欧洲的德国、法国、奥地利等国家,以及东南亚的越南、马来西亚等国家。
3月3日,九强生物在互动平台称,经过生物信息学的比对情况分析,公司的新型冠状病毒抗原检测试剂盒可以检测奥密克戎新型冠状病毒突变毒株。公司的新冠检测试剂产品在意大利等国已有销售,海外销售前景十分乐观。
 投资避险工具看这里,低风险理财、7%+收益、0手续费>>
投资避险工具看这里,低风险理财、7%+收益、0手续费>>